
Introduzione
La decisione di iniziare l’alimentazione e l’idratazione artificiale (AHN, artificial hydration and nutrition) in una persona affetta da demenza è uno dei nodi decisionali più problematici della cura. I pochi lavori clinici che hanno analizzato questo aspetto hanno messo in evidenza come il processo decisionale sia spesso influenzato da fattori che poco o nulla hanno a che fare con la clinica, il benessere del malato, la sua volontà e il parere dei famigliari (Mitchell et al., 2003; Gessert et al., 2000; Finucane et al., 1999).
Elementi che incidono nella decisione di alimentare artificialmente un malato con demenza severa possono essere le dimensioni dell’istituto (numero di posti letto), i sistemi di finanziamento, l’appartenenza etnica o lo stato civile del malato (Mitchell et al., 2003). Il percorso che conduce a una scelta così importante, capace di condizionare l’ultima fase della vita di una persona (a volte mesi o anche anni), raramente è il prodotto di un percorso decisionale costruito sulle conoscenze scientifiche e rispettoso del malato e della sua famiglia.
Quando si affronta questo argomento sono almeno tre, a nostro parere, le riflessioni preliminari:
- la prima concerne la scarsità di evidenze scientifiche cui fare riferimento e la difficoltà di ottenerne, in un ambito così complesso, dalle connotazioni etiche profondamente marcate e poco attraente per la ricerca (i dati di cui disponiamo concordano peraltro nel ritenere che l’alimentazione artificiale non sia utile nel prevenire lesioni da decubito, polmoniti ab-ingestis e nell’allungare la vita, e che un’idratazione equilibrata -a volte erroneamente interpretata come disidratazione- incida positivamente sul dolore, sulla tosse e su altri sintomi) (Finucane et al., 1999) (Mitchell et al., 1997) (Gillick, 2000) (Bennett, 2000) (Ganzini et al., 2003);
- la seconda fa riferimento alla cultura palliativista maturata con i malati terminali di cancro o di altre malattie, che ci fornisce preziose indicazioni circa la sensazione di fame e di sete e altre percezioni di fine vita, probabilmente trasferibili per analogia ai dementi (difficile pensare che un malato terminale di demenza abbia esigenze diverse, almeno sul piano neurovegetativo, da quelle di un malato di cancro, e che il rifiuto del cibo che caratterizza questi malati sia estraneo ai dementi);
- la terza riguarda l’incertezza nel definire la fase terminale della malattia, comune a tutte le malattie degenerative, ma particolarmente accentuata nel caso della demenza che, come si sa, ha un decorso lento, lungo, di durata media ancora controversa (Mölsa et al., 1986; Walsh et al., 1990; Wolfson et al., 2001; con fasi cliniche mal definite e un’aspettativa di vita molto incerta (Mitchell et al., 2004).
Diventa dunque sempre più pressante, di fronte all’incremento demografico di questi malati e nella logica di un rapporto medico-paziente sempre più orientato all’autodeterminazione, cercare di individuare un processo decisionale cui fare riferimento qualora, per difficoltà di alimentazione, i malati possano richiedere un intervento, senza essere in grado di esprimere, in quel momento e in quella sede, un’opinione motivata e comprensibile.
La letteratura più recente sul decision-making nell’alimentazione artificiale converge su un dato, che ci trova personalmente concordi (The et al., 2002; Monteleoni e Clark, 2004): la necessità che il processo decisionale veda coinvolto il malato (le cui volontà potranno essere espresse in un documento antecedente la malattia, o desunte dalla sua storia, dalle sue opinioni, dalla sua fede e dai suoi valori di riferimento); i famigliari, intesi in senso lato come persone capaci di interpretare i bisogni e la volontà del malato, grazie a una storia personale di consuetudine e legame affettivo; il medico e l’equipe curante, che mai come in questa situazione devono mostrare competenza, cultura, umanità e chiarezza di idee. La presenza contemporanea, armoniosa e non prevaricante di queste tre componenti (malato, famigliari, medico) dovrebbe portare alla decisione migliore, rispettosa della volontà, del benessere del malato e coerente con la sua identità personale (Galletti, 2004).
Il processo decisionale
In qualsiasi forma di demenza si arriva ad una fase in cui la compresenza di svariati problemi clinici e non-clinici rende impossibile un’adeguata alimentazione e idratazione per vie naturali. Questa fase può essere una conseguenza dell’evoluzione naturale della malattia, oppure può essere causata da malattie intercorrenti. In ogni caso la demenza conduce il malato ad una condizione tale per cui la difficoltà di masticazione, la disfagia, l’anoressia e altre componenti non valutabili (depressione?) non sono risolvibili né farmacologicamente né attraverso l’ausilio di tecniche specifiche di nursing.
Nella Figura 1 è riportata la prima fase del processo decisionale che normalmente prende avvio a partire dalla segnalazione da parte degli operatori o dei famigliari, delle difficoltà di alimentazione.
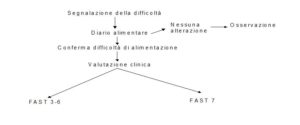
Alla segnalazione deve seguire un’attenta osservazione supportata dalla compilazione, per ogni pasto, di un “diario alimentare” dove venga riportata dagli operatori addetti all’assistenza, l’effettiva alimentazione del paziente. Può infatti accadere che l’impressione di un’alimentazione ridotta sia smentita da una più attenta osservazione. In questo caso è comunque necessario mantenere controllato il paziente, poiché proprio la maggior attenzione nei suoi confronti può avere ridotto o addirittura risolto il problema.
Se l’impressione di un apporto alimentare inadeguato si conferma, il percorso decisionale va diversamente orientato in base al livello funzionale del paziente, valutabile con la scala FAST (Reisberg, 1988). Il processo decisionale è infatti diverso per i pazienti in una fase iniziale/intermedia di malattia (FAST 3-6) e per quelli in fase più avanzata (FAST 7).
Nella Figura 2 vengono presi in considerazione i pazienti in fase FAST 3-6.

Per questa tipologia di pazienti, di fronte ad una ridotta alimentazione, è necessario attivare una valutazione diagnostica (mucositi, patologie dentali, patologie gastroenteriche, depressione, ipovisus ecc..), ambientale (ambienti troppo o troppo poco stimolanti, scarsa o eccessiva attenzione del personale e dei famigliari, tempi di somministrazione troppo veloci…), dietetica (gradevolezza, facilità di assunzione…) e farmacologica. Il controllo degli esami ematici (ematocrito, emoglobina, conta leucocitaria, albumina, transferrina ecc.), del peso corporeo, del BMI porta ad individuare tre possibili situazioni: pazienti normonutriti; pazienti a rischio di malnutrizione (per i quali sono necessarie una supplementazione dietetica e una rivalutazione in tempi brevi) e infine pazienti malnutriti. Per questi ultimi bisognerà intervenire con l’alimentazione e l’idratazione artificiale (AHN): terapia parenterale o enterale (Sondino Naso Gastrico – SNG), se tollerate, e dopo un periodo di tempo ben definito (massimo un mese) sarà necessario rivalutare lo stato nutrizionale.
Se la difficoltà di alimentazione e la conseguente malnutrizione saranno state risolte, si tornerà all’alimentazione naturale, programmando controlli del peso corporeo e degli esami ematici in tempi ravvicinati; al contrario se la situazione non è cambiata, il processo decisionale prevede una valutazione prognostica e un confronto con i famigliari (possibilmente orientato da disposizioni anticipatamente rilasciate dal paziente), con l’obiettivo di effettuare la scelta che, in quel momento, riflette la volontà dell’interessato.
Due le vie decisionali da perseguire:
- la prosecuzione di una AHN per più lunga durata (PEG o PEJ), che non dovrà precludere la possibilità di riprendere la nutrizione per via naturale dopo un’ulteriore valutazione;
- l’interruzione dell’AHN. La degenerazione della condizione del paziente sino ad uno stato di terminalità, la presenza di Direttive Anticipate (D.A.) che esprimano l’intenzione di non mantenere una nutrizione artificiale e l’approvazione dei familiari per questo tipo di condotta portano all’ interruzione dell’AHN e all’inizio di una terapia palliativa.
Per il paziente in fase FAST 7 è previsto un processo analogo ma più articolato (Figg. 3 e 4).
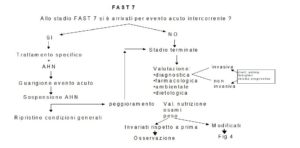
Il disturbo nutrizionale in questa fase può riflettere un improvviso peggioramento dello stato funzionale del paziente determinato da una patologia acuta intercorrente. L’AHN (Nutrizione Parenterale o Nutrizione Enterale) va in questo caso effettuata in parallelo con la terapia specifica in corso. Il superamento della fase acuta può riportare il paziente alla condizione precedente all’evento; le condizioni generali possono invece peggiorare, decretando il passaggio alla fase terminale.
Se alla fase 7 si è approdati al termine di una malattia acuta o se si tratta invece della fase terminale, conclusione naturale della malattia di Alzheimer, il processo decisionale, per un paziente che non si alimenta a sufficienza, prevede le valutazioni già viste per la fase 3-6. In questo caso però è previsto, sin dal primo passaggio (la valutazione diagnostica), qualora si debbano effettuare interventi invasivi, l’inserimento di una serie di elementi di cui tener conto (possibilità terapeutiche, presenza di D.A., condivisione con la famiglia). Anche il passaggio successivo, la valutazione dello stato nutrizionale, dovrà indagare non cosa si discosta dalla normalità ma cosa è variato rispetto a quel paziente. Quando la valutazione dello stato nutrizionale conferma la malnutrizione, nuovamente dovranno essere presi in considerazione le D.A., il parere dei famigliari, la comorbilità ed eventualmente, affinché il curante si possa sentire rassicurato da un indice oggettivo, la valutazione prognostica, attraverso strumenti come il Mortality Risk Index Score (Michell et al. 2004).
Le Direttive Anticipate e il confronto con i famigliari ci indirizzeranno verso due percorsi alternativi.
- Se il paziente (attraverso le D.A.) e i familiari non sono d’accordo con una AHN, dovremo cercare le possibili alternative alimentari naturali (alimenti altamente energetici una sola volta al giorno, piccoli pasti frazionati…); si potrà inoltre mantenere un idratazione e.v. o ipodermo di 500-700 cc., avendo cura che tutto ciò non provochi inutili sofferenze (ad es. numerosi tentativi per posizionare una terapia e.v.). Se la condizione andrà costantemente peggiorando, sarà importante, così come per i pazienti neoplastici terminali (Volicer, 1998), eliminare il senso di arsura alla bocca con spray umettanti o altre metodiche.
- Se invece il paziente e la famiglia optano per una AHN, questa dovrà essere iniziata, ma programmata per un tempo limitato. Al termine dovrà essere rivalutata la possibilità di riprendere una seppur parziale nutrizione naturale. Se questa risulta ancora impossibile e la decisione di mantenere una nutrizione artificiale è ancora salda, si manterrà l’AHN (SNG O PEG). Se invece le condizioni del paziente sono peggiorate e la famiglia non riesce più a supportare la decisione iniziale perché si è arrivati alla sensazione di accanimento terapeutico, il paziente sarà trattato con la sola terapia palliativa con il supporto etico del principio della non maleficienza.

Conclusioni
Il decorso della demenza è caratterizzato da decisioni che difficilmente -e solo nella fase iniziale della malattia- vengono assunte dal malato. Nella maggior parte dei casi la persona malata è l’oggetto di scelte fatte dal medico, dai famigliari o da entrambi. In particolare, la scelta di alimentare artificialmente ha una portata etica, una valenza simbolica e una dimensione clinica raramente riscontrabili in altre situazioni. Purtroppo manca, nel nostro Paese, uno strumento efficace e legalmente riconosciuto che ci consenta di interpretare la volontà del malato, quando questi non è più in grado di esprimerla: le Direttive Anticipate (advance directive), intese come una serie di indicazioni date anticipatamente dall’interessato, relative a scelte sanitarie, compresa la nomina di un referente (health care proxy) cui delegare le decisioni; una dichiarazione preventiva (advance statement) che in modo più generale espliciti i principi dell’interessato e i suoi valori di riferimento.
Pur in assenza di strumenti legislativi in grado di supportare efficacemente la decisione in tutti i suoi passaggi, ci sembra corretto sul piano etico, oltre che su quello deontologico e clinico, seguire un algoritmo decisionale che bilanci costantemente la fase clinica della malattia e l’aspettativa di vita del malato, con quella che noi (curanti e famigliari) riteniamo essere in quel momento la volontà dell’interessato. Uno strumento di decision-making, quello che proponiamo, a nostro giudizio sufficientemente garantista, tale da evitare i rischi dell’accanimento terapeutico e, all’opposto, dell’abbandono assistenziale.
Bibliografia
Bennett JA. Dehydration: hazards and benefits. Geriatr Nurs 2000; 21 (2): 84-88.
Finucane TE, Christmas C, Travis K. Tube feeding in patients with advanced dementia: a review of the evidence. JAMA, 1999, 282: 1365-1370.
Galletti M. Identità personale e testamento biologico: il caso della malattia di Alzheimer. Bioetica, 2004; 3:400-12.
Ganzini L, Goy ER, Miller LL, Harvath TA, Jackson A, Delory MA. Nurses’ experience with hospice patients who refuse food and fluids to hasten death. N Engl J Med, 2003; 349: 359-65.
Gessert CE, Mosier MC, Brown EF, Frey B. Tube feeding in nursing home residents with severe and irreversible cognitive impairment. JAGS, 2000; 48:1593-1600.
Gillick MR. Rethinking the role of tube feeding in patients with advanced dementia. N Engl J Med, 2000, 342: 206-10.
Mitchell SL, Kiely DK, Lipsitz LA. The risk factors and impact on survival of feeding tubes in nursing home residents with severely advanced dementia. Arch Intern Med, 1997; 157: 327-332.
Mitchell SL, Teno JM, Roy J, Kabumoto G, Mor V. Clinical and organizational factors associated with feeding tube use among nursing home residents with advanced cognitive impairment. JAMA, 2003; 290 (1): 73-80.
Mitchell SL, Kiely DK, Hamel MB, Pak PS, Morris JN, Fries BE. Estimating Prognosis for Nursing Home Residents With Advanced Dementia. JAMA, 2004; 291(22): 2734-40.
Mölsa PK, Martilla RJ, Rinne UK. Survival and cause of death in Alzheimer’s disease and multi-infarct dementia. Acta Neurol Scand 1986;74:103-107.
Monteleoni C, Clark E. Using rapid-cycle quality improvement methodology to reduce feeding tubes in patients with advanced dementia: before and after study. BMJ, 2004; 329: 491-94.
Reisberg B. Functional assessment staging (FAST). Psychopharmacol Bull. 1988; 24: 653-59.
The A-M, Pasman R, Bregie O-P, Ribbe M, van der Waal G. Withholding the artificial administration of fluids and food from elderly patients with dementia: ethnographic study. BMJ, 2002; 325: 1326-29.
Volicer L. Tube feeding in Alzheimer’s disease is avoidable. J Nutr Health Aging. 1998; 2 (2):122-23.
Walsh JS, Welch HG, Larson EB. Survival of outpatients with Alzheimer-type dementia. Ann Intern Med 1990;113:429-34.
Wolfson C, Wolfson DB, Asgharian M, M’Lan CE, Ostbye T, Rockwood K, Hogan DB; Clinical Progression of Dementia Study Group. A reevaluation of the duration of survival after the onset of dementia. N Engl J Med 2001;344:1111-1116.












