
Introduzione
La demenza è una sindrome clinica (Diagnostic and statistical manual of mental disorders, 1994) non curabile, evolutiva, che porta inevitabilmente alla morte. Essa è caratterizzata dalla perdita delle funzioni cognitive, tra le quali la memoria, di entità tale da interferire con le usuali attività sociali e lavorative. La prevalenza della malattia aumenta con l’età, ed è maggiore nel sesso femminile, soprattutto per la malattia di Alzheimer. La prevalenza di demenza negli istituti per non autosufficienti varia dal 15 fino all’80% (Macdonald, 1997).
Nel “Rapporto Demenza 2006” Alzheimer Europe (Dementia in Europe year book, 2006) si stima che il numero delle persone affette da demenza in Italia nel 2005 sia di poco inferiore al milione, con una prevalenza sulla popolazione tra l’1,4% e l’1,5% (Ferry et al., 2005; The Italian Longitudinal Study on Aging, 1997). La durata media della malattia è incerta, a causa delle difficoltà ad individuarne l’esordio, ma è comunque tra i 3 e i 10 anni (Wolfson et al., 2001; Mölsa et al., 1986; Walsh et al., 1990). Dall’esordio dei sintomi alla morte, chi ne è affetto passa dalla completa autosufficienza alla totale dipendenza, in modo graduale e spesso imprevedibile, essendo condizionato dal tipo di demenza, dall’età, dalle comorbidità, dagli interventi sanitari e assistenziali e dalla rete sociale (McClendon et al., 2004). Nelle fasi avanzate della malattia il ricovero in istituti per anziani è molto frequente (Temkin-Greener e Mukamel, 2002; Mitchell et al., 2004a).
La demenza grave è una malattia terminale, ma solo raramente viene riconosciuta come tale; infatti viene definito a rischio di morte l’1,1% di pazienti, mentre ne muore il 71% (Mitchell et al., 2004a). Sia l’assistenza in RSA che nei distretti si può definire non palliativa (Di Giulio et al., 2008; Galleazzi et al., 2008) e solo pochi pazienti vengono formalmente inseriti in un programma di cure palliative (Hughes et al., 2005; Shega et al., 2003). Esistono importanti differenze di comportamento non solo da paese a paese, ma anche nell’ambito della stessa realtà territoriale (Morrison e Siu, 2000).
La gestione dell’alimentazione, dell’idratazione artificiale, della contenzione, le decisioni relative agli interventi di rianimazione, emodialisi, somministrazione di antibiotici e trasfusioni sono aspetti comuni alla cura di tutti i malati fortemente compromessi ma, in un paziente terminale, possono configurarsi come accanimento terapeutico. La decisione di continuarli o sospenderli diventa particolarmente difficile per il malato demente, che non è in condizioni di esprimere una scelta che, in mancanza di una specifica legge, è demandata ai familiari e al personale sanitario (Mitchell et al., 2004b).
Il processo che porta alla decisione di cosa fare, ben lungi dall’essere piano e lineare, è condizionato da riflessioni etiche, giuridiche e cliniche a volte inconciliabili (Degrazia, 1999). Scegliere per conto del paziente presenta notevoli difficoltà (Vig et al., 2006), ed è possibile solo a condizione che chi decide conosca il paziente ed i suoi desideri. I familiari concorrono alla decisione finale, ma dovrebbero essere supportati ed assistiti (Vig et al., 2006; Forbes et al., 2000). Sono disponibili pochi dati italiani sulle decisioni critiche (DTC) (Simionato et al., submitted) e nessuno sul processo decisionale che le motiva. L’obiettivo di questo studio-pilota è proprio di raccogliere dati sulle DTC per mettere a punto il protocollo di ricerca del progetto EOLO PSODEC (End of Life Observatory, Prospective Study of Demented Elderly Care), finalizzato a studiare le DTC nel fine-vita dei malati affetti da demenza grave.
Materiali e metodi
Le DTC sono state individuate in un precedente studio (Simionato et al., submitted): trasfusioni, emodialisi, posizionamento di sonda per alimentazione enterale, nutrizione artificiale (non applicazione/sospensione), idratazione artificiale (non applicazione/riduzione o sospensione), ricovero in ospedale, terapie antibiotiche, sedazione profonda (Società Italiana di Cure Palliative), chirurgia, procedure diagnostiche strumentali. Oltre a queste, ogni altro intervento, sospensione/non attuazione di procedure considerate DTC dall’operatore.
Lo studio ha riguardato i pazienti con demenza grave (Functional Assessment Staging System, FAST ≥ 7) (Sclan e Reisberg, 1992) e prognosi stimata superiore a 15 giorni, degenti in 2 RSA torinesi. Sono stati raccolti i dati socioanagrafici e clinici (comorbidità; stato funzionale, sintomi, stadio della demenza, presenza di presidi invasivi, eventuale uso di contenzione). Per sei settimane, ogni 15 giorni sono state documentate sia le condizioni generali, descrivendo le situazioni che avessero comportato una DTC, sia le motivazioni sottostanti ad ogni DTC, raccolte con una scheda compilata dall’operatore o da un monitor mediante intervista.
Il livello di discomfort è stato misurato con la versione italiana della Discomfort Scale-Dementia of alzheimer Type (DS-DAT) (Dello Russo et al., 2008), che attribuisce punteggi da 5 a 30: più elevato il punteggio, maggiore il livello di discomfort. Per comprendere meglio le motivazioni alla base delle DTC, sono stati intervistati il medico e l’infermiere responsabili dei pazienti. Nell’intervista sono stati esplorati i seguenti aspetti: obiettivi della decisione, persone coinvolte, elementi considerati per prendere la DTC. Le interviste in profondità, semistrutturate, della durata di circa 1 ora, si sono svolte presso le due sedi di cura. I contenuti emersi sono stati raggruppati secondo aree tematiche in base al quadro concettuale proposto da Vig (Vig et al., 2006), in particolare per la condivisione della scelta con i caregiver. Alcune affermazioni, citate in base ad un criterio di rappresentatività tematica, sono state riportate specificando la qualifica professionale dell’intervistato (M = Medico; I = Infermiere).
Consenso e privacy
Poiché l’assistenza del paziente non ha subito nessuna modifica, e che i dati raccolti sono quelli normalmente documentati di routine, non è stato chiesto il consenso né ai pazienti né ai familiari. Le schede di raccolta dati sono state rese anonime in modo da non consentire l’identificazione del paziente a cui si riferivano. È stata resa anonima anche l’intervista agli operatori sanitari, intervistati previo consenso, sia per l’intervista che per la sua registrazione.
Risultati
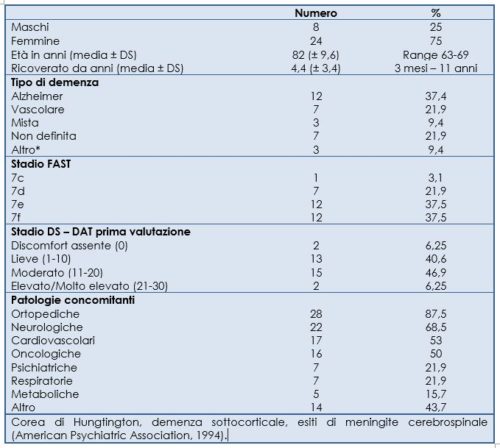
I dati sono stati raccolti fra dicembre 2006 e febbraio 2007. Sono stati selezionati 32 pazienti. Le principali caratteristiche dei pazienti sono descritte nella Tabella 1. I pazienti erano ricoverati da un tempo che ne consentisse una buona conoscenza da parte del personale; erano affetti da 2 a 6 stati morbosi contemporaneamente (mediana 4), situazione che giustificava l’assunzione di più farmaci (22 pazienti da 4 a 9 farmaci); 17 assumevano psicofarmaci. Ventitre presentavano anchilosi e contratture, segni di una lunga immobilizzazione o permanenza a letto. Solo 5 avevano un catetere vescicale e 1 un catetere venoso centrale.
Tre si alimentavano sia per os sia con sondino nasogastrico (SNG), e tre con PEG; gli altri solo per via orale; 11 pazienti venivano idratati anche per via endovenosa (di questi, uno aveva la PEG ed uno il SNG). Tutti i pazienti erano contenuti con spondine, 24 ore su 24, e 6 anche con cintura pelvica o addominale. La metà aveva un discomfort moderato e solo 2 di livello elevato. Un paziente è deceduto durante lo studio, dopo circa 40 giorni.
Decisioni terapeutiche critiche
Sono state prese 16 decisioni considerate critiche per 10 pazienti (3 per un paziente e 2 per 4). La decisione più frequente è stata il ricorso ad un antibiotico (6 pazienti, 7 decisioni), per un’ipertermia. Tre pazienti sono stati sedati (uno in due occasioni) per un’agitazione psicomotoria non altrimenti controllabile. In due casi è stata impostata un’idratazione endovenosa per un aggravamento della disfagia, scegliendo di non posizionare la PEG. In un caso è stato deciso il trasferimento in ospedale per un sospetto di polmonite e, in un altro, è stato pianificato (e poi sospeso per volere dei parenti) un intervento chirurgico di correzione della spasticità degli arti inferiori. Solo uno dei pazienti per i quali sono state prese DTC presentava un livello di discomfort elevato (DS-DAT 27).
Obiettivi della DTC
Sono stati intervistati 2 medici e 2 infermieri. L’obiettivo principale, alla base di tutte le scelte, era di ridurre i sintomi e la sofferenza e migliorare la qualità della vita: “La somministrazione della morfina, detendendo il paziente, facilita la respirazione, oltre a ridurre il dolore, ed il paziente sta davvero meglio” (M). A questa attenzione si contrappone, però, quella di evitare un accorciamento della vita “Siamo tra gli ultimi Paesi nella somministrazione della morfina, lo so, conosco le raccomandazioni. Ma è difficile, quando il paziente soffre, ci consultiamo, controlliamo l’effetto della somministrazione, perché non sia quello a provocare la morte” (M). L’orientamento è di non prolungare la sopravvivenza tout court e di evitare terapie ed interventi eccessivi “fortunatamente siamo abbastanza distanti dalla diagnostica invasiva dell’ospedale e dalla rianimazione” (M). Tuttavia, uno stato critico di salute mette in difficoltà. “Ci troviamo sempre a camminare sul crinale incerto sospeso tra l’etica e la deontologia professionale, gli aspetti legali e le richieste dei parenti. Certo, noi ci occupiamo del benessere del paziente, ma in un certo senso anche del parente. Bisogna trovare l’equilibrio nella scelta” (M).
Le persone coinvolte Gli intervistati si sono sentiti in difficoltà nella scelta, sia per la mancanza di un quadro normativo, sia per l’incertezza delle fonti dalle quali desumere le volontà dei malati. Infatti, nessun paziente aveva lasciato disposizioni chiare né direttive anticipate, e quanto riportato dai parenti non aveva modo di essere verificato. “L’incontro tra le esigenze terapeutiche e ciò che riportano i parenti è qualcosa che, in mancanza del living will, ci mette in difficoltà. Sentiamo il dubbio che dietro la fretta di interrompere le cure ci siano ragioni lontane dal volere della persona assistita” (M).
Anche la richiesta di continuare le cure non genera meno problemi perché può essere determinata da elementi che possono prescindere dal volere della persona assistita, ad esempio, la difficoltà ad accettare la morte del proprio congiunto “All’ultimo momento il marito, preso atto dei rischi anestesiologici, ha deciso di non dare più il consenso. La ragione di vita del marito risiede nella sopravvivenza della moglie, sebbene sofferente e completamente assente dal punto di vista cognitivo (signora che doveva essere sottoposta ad intervento chirurgico per ridurre gli effetti dolorosi di un’importante anchilosi agli arti inferiori)” (I).
La conoscenza della persona assistita e del suo familiare permette di elaborare la decisione: “Ci siamo incontrati col figlio ed il medico molte volte per capire cosa era e cosa avrebbe comportato il posizionamento di una PEG” (I). Potersi confrontare con un familiare del paziente è considerato con sollievo e, spesso, questa opportunità manca: “Il momento della scelta è sempre solitario. Ci sono i criteri, ci sono i protocolli, ma poi bisogna che la decisione la prendiamo noi qui, io ed il gruppo di infermieri, ed è difficilissimo perché è sempre senza rete, è sempre tutto nuovo” (M). Col familiare è possibile pianificare l’assistenza, prospettandogli le situazioni che si potrebbero realizzare, e le opzioni possibili. Nelle fasi più critiche, ciò può richiedere numerosi incontri. Quando però non esiste un parente con cui dialogare, “allora sono gli infermieri che si fanno portavoce della storia dell’ospite che conoscono, spesso da molto tempo” (M).
Prevale l’estremo rispetto per la volontà dei parenti, anche se a volte è in contrasto con quanto medici ed infermieri avrebbero suggerito. Viene sottolineata la difficoltà della scelta, ma anche l’impossibilità di adottare regole e criteri univoci. A uno degli ospiti per cui era stato scelto di non posizionare la PEG, è stata poi impiantata perché, a distanza di un mese, il parente ha insistito fortemente. “Come medico non vorrei un protocollo per il paziente terminale: questo è un ambito in cui le scelte devono essere prese attraverso una valutazione continua della situazione” (M).
Elementi che hanno motivato la scelta
La scelta di cosa fare (se trattare o meno il paziente) è influenzata dalla percezione della sua condizione di terminale. Due eventi sono considerati predittivi dell’inizio della fase di terminalità: la disfagia e l’iporeattività. Quando il malato si avvia su questa strada, viene accompagnato secondo la modalità ritenuta meno invasiva, ma in linea di massima, attivando l’idratazione e talvolta l’alimentazione, anche tramite un catetere venoso centrale: “Io credo che l’acqua e l’alimentazione si debbano mantenere” (M).
Più discusso è l’uso dell’antibiotico in presenza di polmonite: un medico ricorda che “il Prof. XX sosteneva sempre che la polmonite è il miglior amico del vecchio, e tuttavia è difficile decidere di non intraprendere un trattamento, come nel caso della paziente con polmonite, dove sembra che ci sia ancora riserva vitale”. Quando si verifica un evento acuto emerge una gradualità nella scelta degli interventi: “Se ho un paziente con edema polmonare, fortemente deteriorato, iniziamo con un tentativo di intervento di cura importante nel periodo immediatamente successivo all’evento e, se la persona non dà risposta, allora interrompiamo e trattiamo il dolore e idratiamo” (M). L’orientamento è quello di non anticipare la morte del malato, rivalutando continuamente le sue condizioni.
Discussione
I 2/3 dei pazienti, nonostante lo stadio FAST ≥ 7, le numerose comorbidità, ed una situazione che può essere definita grave, rimangono sostanzialmente stabili nel tempo (McClendon et al., 2004; Morrison e Siu, 2000; Mitchell et al., 2004b). Le DTC vengono prese con una certa frequenza (16 decisioni in un mese e mezzo per 10 pazienti). Una DTC può essere modificata in base alla storia del paziente, pertanto è necessario che la situazione venga seguita per un periodo sufficientemente lungo, per capire se modificare la scelta. Le scelte percepite come critiche restano ben presenti nella memoria sia del medico sia dell’infermiere, consentendo quindi, anche a distanza di 15 giorni dall’evento, di raccoglierne i dettagli. Le DTC segnalate sono simili a quelle già descritte da altri autori: l’attivazione o l’interruzione dell’alimentazione artificiale e l’idratazione (Morrison e Siu, 2000; Pasman, 2004), il ricorso alla chirurgia (Portenoy et al., 2006), l’utilizzo degli antibiotici (Mitchell et al., 2004b; Pasman, 2004;Van der Steen et al., 2005), della sedazione e della morfina (Mitchell et al., 2004b; Pasman, 2004). A causa della limitatezza del campione e della durata del follow-up, non sono state documentate scelte su sospensione/continuazione/attivazione di dialisi o trasfusioni (da colloqui informali con le équipe, in linea di massima, la linea di condotta è di non trasfondere).
Dalle interviste emergono una serie di aspetti, importanti per ricostruire lo scenario che ha portato alla scelta:
- La valutazione delle condizioni dei pazienti e la stima generale della prognosi (Mitchell et al., 2004b). I pazienti inclusi nello studio sono gravi, ma non in imminenza di morte. La difficoltà nel definire quando un paziente è terminale sembra avere un peso nella scelta delle cure (Mitchell et al., 2004a)
- L’esplicitazione dell’obiettivo della scelta. Garantire una buona qualità di vita, con un buon controllo dei sintomi, senza però mettere in atto trattamenti che possano abbreviarne la durata, sembra essere contraddittorio dato che, in molti casi, prolungando la vita si prolunga anche la sofferenza. In un studio su un campione rappresentativo di nursing home americane, per il 53% dei pazienti con demenza grave, affetti da polmonite, in trattamento sintomatico (senza antibiotici), i medici hanno dichiarato di aver anche voluto affrettare il decesso (Van der Steen et al., 2005), proprio perché prolungare la vita di un “morente” comporterebbe prolungarne le sofferenze. I diversi contesti culturali, le convinzioni personali e persino i pregiudizi hanno un peso in questo tipo di decisioni. Tra questi ultimi, resta la convinzione dell’intrinseca pericolosità della morfina, ritenuta farmaco che accelera la morte, per una supposta grave azione depressiva sul respiro anche a dosaggi analgesici
- La storia delle scelte. Le decisioni sono frequentemente modificate. Pasman (Pasman, 2004) sostiene che un approccio palliativista (senza interventi invasivi, ospedalizzazione, idratazione e trattamento antibiotico) contribuisce ad una morte relativamente veloce e priva di sofferenze. Quando però il decesso non avviene in tempi brevi, è difficile continuare a sostenere tale scelta (Pasman, 2004) ed operatori sanitari o parenti necessitano a loro volta di sostegno (Forbes et al., 2000; Rurup et al., 2006b)
- La criticità delle scelte. Mentre è evidente la natura critica di alcune scelte (ad esempio se ricoverare o meno, o inserire una PEG), per altre la definizione di criticità risulta più difficile, come per la somministrazione di antibiotico in un’infezione delle vie urinarie, dove la non somministrazione potrebbe aumentare il discomfort
- La mancanza di direttive anticipate. In Italia non sono legalmente riconosciute le direttive anticipate che invece dovrebbero essere, assieme alla valutazione delle condizioni del paziente (Dello Russo et al., 2008; Rurup et al., 2006b) strumento essenziale per decidere se e quando sospendere i trattamenti aggressivi. Tuttavia, anche nei Paesi in cui sono state adottate, sono poco utilizzate. Uno studio olandese (Pasman, 2004) riporta che le aveva espresse solo il 4% dei soggetti ricoverati in alcune RSA. Rurup (Rurup et al., 2006a), analizzando le direttive anticipate per fasce d’età, documenta che le ha espresse solo il 7% della popolazione non ricoverata. Vollmann (Vollmann, 2001) sostiene che il processo decisionale sarebbe facilitato da un piano di cure concepito nella primissima parte del ricovero, quando la persona vi può ancora contribuire, definendo le sue direttive anticipate, assieme ai parenti e all’équipe curante. Una decisione condivisa tra le diverse figure professionali è considerata un elemento rassicurante, a conferma della correttezza della decisione presa.
Limiti dello studio
Questo lavoro, configurandosi come una delle tappe del più vasto progetto EOLO-PSODEC (End of Life Obeservatory,Prospective Study of Demented Elderly Care), contribuisce a descrivere il fenomeno, ma non consente alcun tipo di generalizzazione per il tipo di campione di convenienza reclutato, utile alla messa a punto del disegno e degli strumenti dello studio, ma non certo all’individuazione di dati generalizzabili. La tabella 2, relativa alle Decisioni terapeutiche critiche, sarà pubblicata sul sito www.grg-bs.it.
Bibliografia
American Psychiatric Association. Diagnostic and statistical manual of mental disorders (IV ed); Washington, DC, American Psychiatric Association, 1994.
Degrazia D. Advance directives, dementia, and “someone else problem”. Bioethics 1999;13:373-91.
Dello Russo C, Di Giulio P, Brunelli C, Dimonte V, Villani D, Renga G, Toscani F. Validation of the Italian version of the Discomfort Scale- Dementia of Alzheimer Type) on severely demented patients. J Adv Nurs 2008;64:298304.
Dementia in Europe yearbook 2006, Luxembourg 2006.
http:// ec.europa.eu/health/ph_information/reporting/docs/2006_dementiayearbook_en.pdf
Di Giulio P, Toscani F, Villani D, Brunelli C, Gentile S, Spadin P. Dying with advanced dementia in long-term care geriatric institutions: a retrospective study. J Palliat Med 2008;11:1023-8.
Ferry CP, Prince M, Brayne C, Brodaty H, Fratiglioni L, Ganguly M, et al. Global prevalence of dementia: a Delphi consensus study. Lancet 2005; 366:2112-7.
Forbes S, Bern-Klug M, Gessert C. End-of-life decision making for nursing home residents with dementia. J Nurs Scolarship 2000;32(3):251-8.
Galleazzi M, Fantinato M, Toscani F, Di Giulio P, Dimonte V, a nome del gruppo End of Life Observatory (EOLO)-Studio retrospettivo sulle modalità di morte dei pazienti con demenza. I luoghi della cura 2008;4:11-6.
Hughes JC, Robinson L, Volicer L. Specialist palliative care in dementia. BMJ 2005;330:57-8.
Macdonald AJD. Mental health in old age. BMJ 1997;315:413-7. McClendon MJ, Smyth KA, Neundorfer MM. Survival of persons with Alzheimer’s disease: caregiver coping matters. Gerontologist 2004; 44:50819.
Mitchell SL, Kiely DK, Hamel MB. Dying with advanced dementia in the Nursing Home. Arch Intern Med 2004a;164:321-6.
Mitchell SL, Kiely DK, Hamel MB, Pak PS, Morris JN, Fries BE. Estimating prognosis for Nursing Home residents with advanced dementia. JAMA 2004b;291:2734-40.
Mölsa PK, Martella RJ, Rinne UK. Survival and cause of death in Alzheimer’s disease and multi-infarct dementia. Acta Neurol Scand 1986;74:103-7.
Morrison RS, Siu AL. Survival in end-staged dementia following acute illness. JAMA 2000;284:47-52.
Pasman R. Forgoing artificial nutrition and hydration in nursing home patients with dementia. Ponsen & Looijen B.V, Waenngen,NL, 2004.
Portenoy RK, Sibirceva U , Smout R, Horn S, Connor S, Blum RH et al. Opioid use at the end of life: a survey a hospice population. J Pain Symptom Manage 2006;32(6):532-40.
Rurup ML, Onwuteaka-Philipsen BD, van der Heide A, van der Wal G, Deeg DJ. Frequency and determinants of advance directives concerning end-of-life care in Netherlands. Soc Sci Med 2006a;62:1552-63.
Rurup ML, Onwuteaka-Philipsen BD, Pasman HR, Ribbe MW, van der Wal G. Attitude of physicians, nurses and relatives towards end-of-life decisions concerning nursing home patients with dementia. Patient Educ Couns 2006b;61:372-80.
Sclan SG, Reisberg B. Functional Assessment Staging (FAST) in Alzheimer’s disease: reliability, validity and ordinality. Internat Psychogeriatrics 1992;4:55-69.
Shega JW, Levin A, Hougham GW, Cox-Hayley D, Luchins D, Hanrahan P, et al. Palliative excellence in Alzheimer care efforts (PEACE):a program description. J Palliat Med 2003;6(2):315-20.
Simionato L, Toscani F, Villani D, Gentile S, Giunco F, Dimonte V, Di Giulio P Decisions critical for quality of life and survival of severely demented patients (submitted). Società Italiana di Cure palliative. Raccomandazione della SICP sulla sedazione terminale/sedazione palliativa.
www.sicp.it/documenti_pubblici/documenti_sicp/Sedazione.pdf.
Temkin-Greener H, Mukamel DB. Predicting place of death in the Program of All-inclusive Care for the Elderly (PACE): Participant versus Program characteristics. J Am Ger Soc 2002;50:125-35.
The Italian Longitudinal Study on Aging. Prevalence of chronic diseases in older Italians: comparing self reported and clinical diagnoses. Int J Epidemiol 1997;26:995-1000.
Van der Steen JT, van der Wal G, Mehr DR, Ooms ME, Ribbe MW. End of life decision making in nursing home residents with dementia and pneumonia: Dutch physicians’ intention regarding hastening death. Alzheimer Dis Assoc Disord 2005;29:148-54.
Vig EK, Taylor J, Starks H, Hopley EK, Fryer-Edwards K. Beyond substituted judgement: how surrogates navigate end of life decision-making. JAGS 2006; 54:1688-93.
Vollmann J. Advanced directives in patients with Alzheimer’s disease. Ethical and clinical considerations. Med Health Care Philos 2001;4:161-7.
Walsh JS, Welch HG, Larson EB. Survival of outpatients with Alzheimertype dementia. Ann Intern Med 1990;113:429-34.
Wolfson C, Wolfson DB, Ascharian M, M’Lan CE, Østibe T, Rockwood K, 6 et al. A reevaluation of the duration of survival after the onset of dementia. N Engl J Med 2001;344:1111-6.












